'关于核盘菌的简要概述'
Author(s): агроном Керанка Жечева, Добруджански земеделски институт – гр. Генерал Тошево, ССА; проф. д-р Иван Киряков, Добруджански земеделски институт – гр. Генерал Тошево, ССА
Date: 11.04.2025
879
摘要
核盘菌(Sclerotinia sclerotiorum)是一种植物病原真菌,可侵染75个植物科中的400多种植物。该病原菌造成的产量损失可达100%。在保加利亚的条件下,核盘菌是多种工业作物、蔬菜作物和食用豆类作物的关键病害。本出版物提供了关于该真菌的分布、症状学、致病机理和防治措施的简要信息。
核盘菌(Sclerotinia sclerotiorum (Lib.) de Bary)是一种多食性病原菌,可侵染75个植物科中的400多种植物,主要为双子叶植物(Boland and Hall 1994)。该真菌属于子囊菌门(Ascomycota),锤舌菌纲(Leotiomycetes)。该病原菌已在欧洲、非洲、亚洲、北美洲、中美洲和加勒比地区、澳大利亚和新西兰等100多个国家被报道(Saharan and Mehta, 2008; Cohen, 2023)。在保加利亚,该病原菌是相当数量的工业作物、豆类作物和蔬菜作物的关键病害。该真菌造成的损害与植物种类、基因型的抗性、受侵染的器官以及土壤和气候条件有关,变化范围很大,可达100%(Vasconcellos et al., 2017; Rather et al., 2022)。

图 1. 核盘菌在普通菜豆上引起的症状
由核盘菌引起的病害根据寄主和受侵染的植物器官而有不同的名称(菌核萎蔫病、菌核腐烂病、白腐病、白霉病、根腐病、茎腐病)(Steadman, 1983; Bolton et al., 2006; Saharan and Mehta, 2008)。病害症状很容易识别,因为在受感染组织表面会形成白色棉絮状菌丝体(Hossain et al. 2023)。最初,在受影响的组织上形成不同大小和形状的水渍状斑点,随后褪色,受感染的组织死亡。

图 1a. 核盘菌在向日葵上引起的症状(茎部型)
在潮湿条件下,白色棉絮状菌丝体在受影响组织上积累,随后压实并形成称为菌核的黑色结构(图 1 和 1a)。菌核也可以在受感染的器官内部形成。
菌核是初次侵染的主要来源。其存活时间受土壤类型、湿度、温度及其在土壤中的位置等因素影响。已确定在干燥条件下,菌核可保持活力7至10年(Adams and Ayers, 1979)。

图 2. 在湿润滤纸上形成新菌核(箭头指示)。
我们进行的一项实验表明,将菌核置于4°C湿润滤纸上40天,会导致其菌丝发育并形成新菌核(图 2)(Zhecheva et al. 2024)。这些结果表明,该真菌在缺乏寄主的情况下也能增加其种群数量。
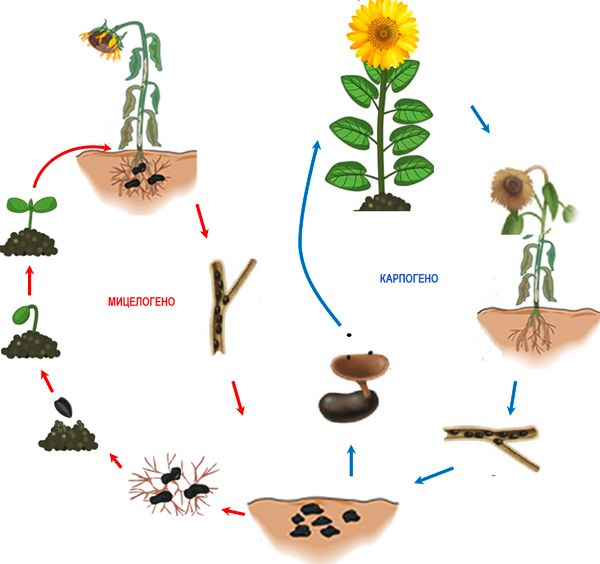
图 3. 核盘菌在向日葵上的生活史
寄主的侵染遵循两种主要模式(图 3)。位于根系附近或与土壤接触的植物器官附近的菌核萌发产生菌丝(菌丝型发育),菌丝在组织表面定殖,同时产生草酸(Hegedus and Rimmer, 2005; Hossain et al., 2023)。产生的草酸抑制细胞的防御机制,同时提高细胞壁降解酶(CWDEs)的效率(Hegedus and Rimmer, 2005)。第二种模式与真菌进入有性生殖阶段(子实体型发育)有关,这导致形成称为子囊盘(图 4)的子实体,从中释放出大量子囊孢子(Hegedus and Rimmer, 2005)。每个子囊盘在7天内可释放多达1000万个子囊孢子,这些孢子随气流传播,距离可达3-4公里。子囊孢子降落在植物花朵上后,萌发并定殖于衰老的器官(花瓣、萼片、花粉等),随后侵染邻近组织。植物湿润16-48小时以及温度在12至24°C之间有利于侵染。大多数研究表明,菌核要进入子实体型发育,需要数月的预条件处理,在此期间菌核保持在0至5°C的温度和高湿度下(Sanogo and Puppala, 2007)。降雨和20-25°C范围内的最佳温度有利于子囊盘和子囊孢子的形成,但子囊盘也可以在5°C(Wu et al., 2008; Phillips, 198; Sanogo and Puppala, 2007; Godoy et al., 2017)或10-15°C(Gupta and Singh, 2017)下形成。只有位于土壤表面或3-5厘米深度的菌核才能形成子囊盘(Godoy et al. 2017)。

图 4. 核盘菌中子囊盘的起始和形成
单个菌核上形成的子囊盘数量取决于其大小,从几个到几十个不等。我们在田间条件下进行的一项实验表明,10月份放置在土壤表面并用小麦和玉米植物残体覆盖的菌核,在3月底开始形成子囊盘(未发表数据)。在没有植物残体和用向日葵植物残体覆盖的处理中未检测到子囊盘起始。这些结果表明,土壤表面存在植物残体由于能保持高湿度,有利于菌核的子实体型发育。
在保加利亚的条件下,核盘菌主要表现为菌丝型发育(Saharan and Mehta, 2008; Genchev and Kiryakov 2002)。这一事实决定了该病原菌的防治策略。轮作是控制该真菌的主要预防措施(Saharan and Mehta, 2008)。建议在已证实有该病原菌发生的田块,4-5年内不要种植寄主作物。遵守播种期和播种密度也可以限制病原菌的表现和发展。春季作物较早播种会因菌核的菌丝型发育而导致幼苗死亡(O’Sullivan et al., 2021)。高播种密度会创造长时间保持湿度的条件,在菌核进行子实体型发育的情况下有利于子囊盘的形成(McDonald et al. 2013)。
使用抗性品种或杂交种被认为是控制病害最有效和高效的措施(Schwartz and Singh, 2013)。对核盘菌的抗性是数量性状,这使抗性育种变得复杂(Genchev and Kiryakov, 2002; Schwartzand and Singh, 2013)。例如,向日葵杂交种的抗性与病害发展形式——基部腐烂、茎腐和头腐有关(Castaño et al., 1993; Van Becelaere and Miller, 2004; Davar et al., 2010)。我们的研究表明,对茎部型具有抗性的杂交种对病害的基部型易感。在普通菜豆中,报道了两种抗性机制(Miklas et al., 2012; Schwartz and Singh, 2013)。第一种与植株生长习性有关。直立生长习性的品种由于作物通风更好、湿度降低,可以防止开花期感染。同时,它们将地上器官(茎、叶和豆荚)置于一定高度,防止其与土壤表面接触,从而在菌核进行菌丝型发育的情况下防止感染。第二种抗性机制与植物的解剖特征有关,这些特征阻碍病原菌进入组织。这种抗性被称为生理抗性(Griffiths, 2009; Miklas et al., 1999; Mkwaila et al., 2011; Pascual et al., 2010)。
使用杀菌剂是控制栽培植物病害最受青睐的方法之一。对于核盘菌,当存在病原菌子实体型发育的风险时,即植物在开花期受到攻击时,施用杀菌剂是合理的(Peltier et al., 2012; Derbyshire and Denton-Giles, 2016; O’Sullivan et al., 2021)。用杀菌剂处理种子可以防止植物发育早期的感染(Peltier et al., 2012)。在菌核进行菌丝型发育直接攻击植物地上部生物量的情况下,施用杀菌剂效果不佳。
参考文献
1. Adams, P. B., & Ayers, W. A. (1979). Ecology of Sclerotinia species. Phytopathology, 69(8), 896-899.
2. Boland, G. J., & Hall, R. (1994). Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology, 16(2), 93-108.
3. Bolton, M.D, Thohmma, B.P.H.J. & Nelson, B.D. (2006). Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, 7(1), 1–16
4. Castaño, F., Vear, F., & de Labrouhe, D. T. (1993). Resistance of sunflower inbred lines to various forms of attack by Sclerotinia sclerotiorum and relations with some morphological characters. Euphytica, 68(1), 85-98.
5. Cohen, S. D. (2023). Estimating the climate niche of Sclerotinia sclerotiorum using maximum entropy modeling. Journal of Fungi, 9(9), 892
6. Davar, R., Darvishzadeh, R., Majd, A., Ghosta, Y., & Sarrafi, A. (2010). QTL mapping of partial resistance to basal stem rot in sunflower using recombinant inbred lines. Phytopathologia Mediterranea, 49(3), 330-341.
7. Derbyshire, M. C., & Denton-Giles, M. (2016). The control of sclerotinia stem rot on oilseed rape (Brassica napus): current practices and future opportunities. Plant Pathol. 65, 859–877. doi: 10.1111/ppa.12517
8. Genchev, D., & Kiryakov, I. (2002). Inheritance of resistance to white mold disease (Sclerotinia sclerotiorum (Lib.) de Bary) in the breeding line A195 of common bean (Phaseolus vulgaris L.).
9. Godoy, O., Stouffer, D. B., Kraft, N. J. & Levine, J. M. (2017). Intransitivity is infrequent and fails to promote annual plant coexistence without pairwise niche differences. Ecology, https://doi.org/10.1002/ecy.1782
10. Griffiths, P. D. (2009). Release of Cornell 601–606: common bean breeding lines with resistance to white mold. HortScience, 44(2), 463-465.

![MultipartFile resource [file_data]](/assets/img/articles/заглавна-обзор-керанка.jpg)



