Breve visão geral de Sclerotinia sclerotiorum
Author(s): агроном Керанка Жечева, Добруджански земеделски институт – гр. Генерал Тошево, ССА; проф. д-р Иван Киряков, Добруджански земеделски институт – гр. Генерал Тошево, ССА
Date: 11.04.2025
887
Resumo
Sclerotinia sclerotiorum é um fungo fitopatogênico que ataca mais de 400 espécies de plantas de 75 famílias botânicas. As perdas de rendimento causadas pelo patógeno podem chegar a 100%. Nas condições da Bulgária, S. sclerotiorum é uma praga-chave em várias culturas industriais, hortícolas e de leguminosas grão. A presente publicação fornece informações breves sobre a distribuição, sintomatologia, patogênese e medidas de controle do fungo.
Sclerotinia sclerotiorum (Lib.) de Bary é um patógeno polífago que ataca mais de 400 espécies de plantas, principalmente dicotiledôneas, de 75 famílias botânicas (Boland e Hall 1994). O fungo pertence ao filo Ascomycota, classe Leotiomycetes. O patógeno foi relatado em mais de 100 países na Europa, África, Ásia, América do Norte, América Central e Caribe, Austrália e Nova Zelândia (Saharan e Mehta, 2008; Cohen, 2023). Na Bulgária, o patógeno é uma praga-chave em um número considerável de culturas industriais, de leguminosas e hortícolas. Os danos causados pelo fungo estão relacionados à espécie vegetal, à resistência dos genótipos, aos órgãos atacados e às condições edafoclimáticas, e variam amplamente, podendo chegar a 100% (Vasconcellos et al., 2017; Rather et al., 2022).

Figura 1. Sintomas causados por Sclerotinia sclerotiorum em feijão comum
As doenças causadas por Sclerotinia sclerotiorum recebem nomes diferentes dependendo do hospedeiro e dos órgãos da planta que são atacados (murcha de Sclerotinia, podridão de Sclerotinia, podridão branca, mofo branco, podridão radicular, podridão do caule) (Steadman, 1983; Bolton et al., 2006; Saharan e Mehta, 2008). Os sintomas da doença são facilmente reconhecíveis, devido à formação de micélio branco e cotonoso na superfície dos tecidos infectados (Hossain et al. 2023). Inicialmente, manchas encharcadas de tamanho e forma diferentes são formadas nos tecidos afetados, que subsequentemente murcham, e os tecidos infectados morrem.

Figura 1a. Sintomas causados por Sclerotinia sclerotiorum em girassol (forma do caule)
Sob condições de umidade, micélio branco semelhante a algodão se acumula nos tecidos afetados, que subsequentemente se compacta e forma estruturas negras conhecidas como escleródios (Fig. 1 e 1a). Escleródios também podem ser formados dentro dos órgãos infectados.
Os escleródios são a principal fonte de infecção primária. A duração de sua sobrevivência é influenciada por fatores como tipo de solo, umidade e temperatura, e sua posição no solo. Está estabelecido que, sob condições secas, os escleródios podem permanecer viáveis por um período de 7 a 10 anos (Adams e Ayers, 1979).

Figura 2. Formação de novos escleródios (setas) em papel de filtro umedecido.
Um experimento conduzido por nós mostra que a colocação de escleródios em papel de filtro umedecido a 4°C por 40 dias leva ao seu desenvolvimento micelial e à formação de novos escleródios (Fig. 2) (Zhecheva et al. 2024). Esses resultados indicam que o fungo pode aumentar sua população na ausência de hospedeiros.
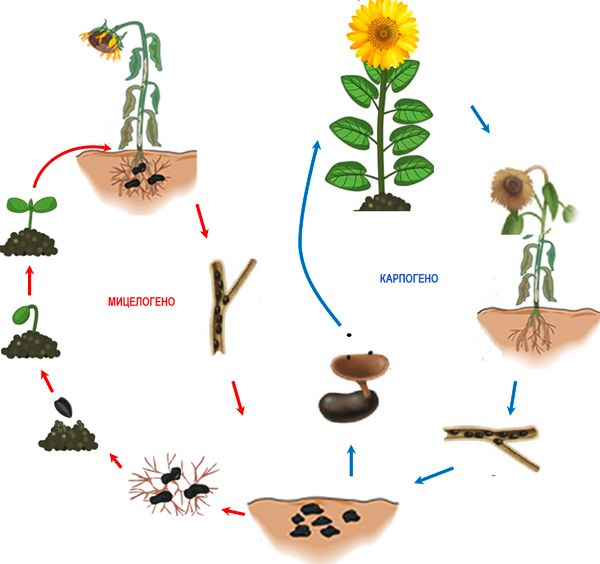
Figura 3. Ciclo de vida de Sclerotinia sclerotiorum em girassol
A infecção dos hospedeiros segue dois cenários principais (Fig. 3). Escleródios localizados próximos ao sistema radicular ou a órgãos da planta que estão em contato com o solo germinam com micélio (desenvolvimento miceliogênico), que coloniza superficialmente os tecidos enquanto produz simultaneamente ácido oxálico (Hegedus e Rimmer, 2005; Hossain et al., 2023). O ácido oxálico produzido suprime os mecanismos de defesa das células enquanto aumenta a eficiência das enzimas degradadoras da parede celular (CWDEs) (Hegedus e Rimmer, 2005). O segundo cenário está relacionado ao fungo entrar em um ciclo sexual (desenvolvimento carpogênico), o que leva à formação de corpos frutíferos chamados apotécios (Fig. 4), dos quais uma quantidade significativa de ascósporos é liberada (Hegedus e Rimmer, 2005). Cada apotécio pode liberar até 10 milhões de ascósporos em 7 dias, que são carregados por correntes de ar e transportados por distâncias de 3–4 km. Após pousarem nas flores das plantas, os ascósporos germinam e colonizam os órgãos senescentes (pétalas, sépalas, pólen, etc.), após o que atacam os tecidos adjacentes. A infecção é favorecida pelo molhamento das plantas por 16–48 h e uma temperatura de 12 a 24 °C. A maioria dos estudos mostra que, para os escleródios entrarem em desenvolvimento carpogênico, é necessário um condicionamento prévio de vários meses, durante o qual os escleródios permanecem a uma temperatura de 0 a 5°C e alta umidade (Sanogo e Puppala, 2007). A presença de chuva e uma temperatura ótima na faixa de 20–25°C favorece a formação de apotécios e ascósporos, mas apotécios também podem ser formados a 5°C (Wu et al., 2008; Phillips, 198; Sanogo e Puppala, 2007; Godoy et al., 2017) ou 10–15°C (Gupta e Singh, 2017). Apenas escleródios localizados na superfície do solo ou a uma profundidade de 3–5 cm formam apotécios (Godoy et al. 2017).

Figura 4. Iniciação e apotécios formados em Sclerotinia sclerotiorum
O número de apotécios formados em um único escleródio depende de seu tamanho e varia de alguns a várias dezenas. Um experimento conduzido por nós em condições de campo mostra que escleródios colocados na superfície do solo e cobertos com resíduos vegetais de trigo e milho em outubro iniciam a formação de apotécios no final de março (dados não publicados). Nenhuma iniciação foi detectada nas variantes sem resíduos vegetais e com resíduos vegetais de girassol. Esses resultados indicam que a presença de resíduos vegetais no solo favorece o desenvolvimento carpogênico dos escleródios devido à manutenção da alta umidade.
Nas condições da Bulgária, Sclerotinia sclerotiorum exibe predominantemente desenvolvimento miceliogênico (Saharan e Mehta, 2008; Genchev e Kiryakov 2002). Este fato determina a estratégia de controle do patógeno. A rotação de culturas é uma medida preventiva importante para o controle do fungo (Saharan e Mehta, 2008). Recomenda-se que, em campos com desenvolvimento comprovado do patógeno, culturas que são hospedeiras não sejam cultivadas por um período de 4–5 anos. O cumprimento das datas de semeadura e das densidades de plantio também pode limitar a manifestação e o desenvolvimento do patógeno. Semeaduras mais precoces de culturas de primavera criam condições para a morte de brotos e plântulas como resultado do desenvolvimento miceliogênico de escleródios (O’Sullivan et al., 2021). Altas densidades de plantio criam condições para a retenção prolongada de umidade, o que favorece a formação de apotécios em casos de desenvolvimento carpogênico de escleródios (McDonald et al. 2013).
O uso de variedades ou híbridos resistentes é considerado a medida mais eficiente e eficaz para o controle da doença (Schwartz e Singh, 2013). A resistência a Sclerotinia sclerotiorum é de natureza quantitativa, o que complica o melhoramento para resistência (Genchev e Kiryakov, 2002; Schwartzand e Singh, 2013). Por exemplo, a resistência de híbridos de girassol está associada à forma de desenvolvimento da doença – podridão basal, do caule e do capítulo (Castaño et al., 1993; Van Becelaere e Miller, 2004; Davar et al., 2010). Nossos estudos mostram que híbridos que possuem resistência à forma do caule são suscetíveis à forma basal da doença. No feijão comum, são relatados dois mecanismos de resistência (Miklas et al., 2012; Schwartz e Singh, 2013). O primeiro está relacionado ao hábito de crescimento da planta. Variedades com hábito de planta ereto previnem a infecção durante a floração devido a uma melhor aeração da cultura e redução da umidade. Ao mesmo tempo, elas posicionam os órgãos aéreos (caules, folhas e vagens) a uma altura que impede seu contato com a superfície do solo, o que previne a infecção em casos de desenvolvimento micelial de escleródios. O segundo mecanismo de resistência está relacionado a características anatômicas das plantas que impedem a penetração do patógeno nos tecidos. Essa resistência é conhecida como fisiológica (Griffiths, 2009; Miklas et al., 1999; Mkwaila et al., 2011; Pascual et al., 2010).
O uso de fungicidas é uma das abordagens mais preferidas para controlar doenças em plantas cultivadas. Com relação a Sclerotinia sclerotiorum, a aplicação de fungicidas é justificada quando há risco de desenvolvimento carpogênico do patógeno, ou seja, quando as plantas são atacadas durante a floração (Peltier et al., 2012; Derbyshire e Denton-Giles, 2016; O’Sullivan et al., 2021). O tratamento de sementes com fungicidas previne a infecção nos estágios iniciais de desenvolvimento das plantas (Peltier et al., 2012). Em casos de ataque direto à biomassa aérea das plantas como resultado do desenvolvimento miceliogênico de escleródios, a aplicação de fungicidas não é eficaz.
Referências
1. Adams, P. B., & Ayers, W. A. (1979). Ecology of Sclerotinia species. Phytopathology, 69(8), 896-899.
2. Boland, G. J., & Hall, R. (1994). Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology, 16(2), 93-108.
3. Bolton, M.D, Thohmma, B.P.H.J. & Nelson, B.D. (2006). Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, 7(1), 1–16
4. Castaño, F., Vear, F., & de Labrouhe, D. T. (1993). Resistance of sunflower inbred lines to various forms of attack by Sclerotinia sclerotiorum and relations with some morphological characters.

![MultipartFile resource [file_data]](/assets/img/articles/заглавна-обзор-керанка.jpg)



