Кратък обзор върху Sclerotinia sclerotiorum
Автор(и): агроном Керанка Жечева, Добруджански земеделски институт – гр. Генерал Тошево, ССА; проф. д-р Иван Киряков, Добруджански земеделски институт – гр. Генерал Тошево, ССА
Дата: 11.04.2025
800
Резюме
Sclerotinia sclerotiorum е фитопатогенна гъба, нападаща над 400 растителни вида от 75 растителни семейства. Загубите в добива, причинявани от патогена, могат да достигнат до 100%. За условията на България S. sclerotiorum е ключов вредител при редица технически, зеленчукови и зърнено-бобови култури. Настоящата публикация представя кратка информация относно разпространението, симптомологията, патогенезата и мерките за контрол на гъбата.
Sclerotinia sclerotiorum (Lib.) de Bary е полифаг, нападащ над 400 растителни, предимно едносемеделни видове от 75 растителни семейства (Boland and Hall 1994). Гъбата е отнесена към отдел Ascomycota, клас Leotiomycetes. Патогенът е съобщен в повече от 100 държави на териториите на Европа, Африка, Азия, Северна Америка, Централна Америка и Карибите, Австралия и Нова Зеландия. (Saharan and Mehta, 2008; Cohen, 2023). В България патогенът е ключов вредител при значителен брой технически, бобови и зеленчукови култури. Щетите, нанасяни от гъбата, са свързани с растителния вид, устойчивостта на генотипите, органите, които са атакувани и почвено-климатичните условия, и варират в широки граници, като могат да достигнат 100% (Vasconcellos et al., 2017; Rather et al., 2022).

Фигура 1. Симптоми причинявани от Sclerotinia sclerotiorum при фасул
Заболяванията, причинявани от Sclerotinia sclerotiorum имат различни наименования в зависимост от гостоприемника и нападнатите растителни органи (склеротинийно увяхване, склеротинийно гниене, бяло гниене, бяла плесен, кореново гниене, стъблено гниене) (Steadman, 1983; Bolton et al., 2006; Saharan and Mehta, 2008). Симптомите на болестта са лесно разпознаваеми, дължащи се на формирането на бял памуковиден мицел по повърхността на нападнатите тъкани (Hossain et al. 2023). Първоначално върху нападнатите тъкани се формират различни по големина и форма воднисти петна, които впоследствие избледняват, а нападнатите тъкани загиват.

Фигура 1а. Симптоми причинявани от Sclerotinia sclerotiorum слънчоглед (стъблена форма)
При влажни условия върху нападнатите тъкани се натрупва бял памукообразен мицел, който впоследствие се сбива и формира черни образования, известни като склероции (фиг.1 и 1а). Склероции могат да се формират и във вътрешността на нападнатите органи.
Склероциите са основният източник на първична инфекция. Продължителността на тяхното запазване се влияе от фактори, като типа, влажността и температурата на почвата, и разположението им в нея. Установено е, че при сухи условия склероциите могат да запазят жизненост за период от 7 до 10 години (Adams and Ayers, 1979).

Фигура 2. Формиране на нови склероции (стрелките) върху навлажнена филтърна хартия.
Проведен от нас експеримент показва, че поставянето на склероциите върху навлажнена филтърна хартия при 4°С за 40 дни води до мицелното им развитие и формиране на нови склероции (фиг. 2)(Zhecheva et al.2024). Тези резултати показват, че гъбата може да увеличава своята популация в отсъствието на гостоприемници.
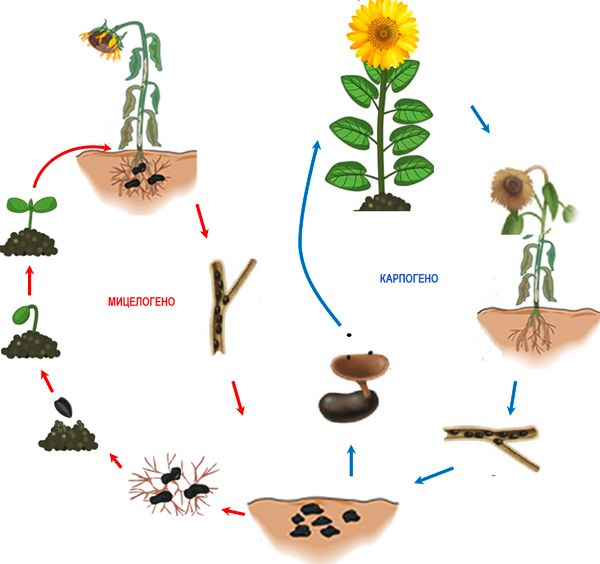
Фигура 3. Цикъл на развитие на Sclerotinia sclerotiorum при слънчоглед
Заразяването на гостоприемниците следва два основни сценария (фиг. 3). Склероциите, разположени в близост до кореновата система или до растителни органи, които са в контакт с почвата, прорастват с мицел (мицелогенно развитие), който колонизира повърхностно тъканите, като успоредно с това продуцира оксалова киселина (Hegedus and Rimmer, 2005; Hossain, et al., 2023). Продуцираната оксалова киселина подтиска защитните механизми на клетките, като успоредно с това повишава ефикасността на ензимите, разграждащи клетъчната стена (CWDEs) (Hegedus and Rimmer, 2005). Вторият сценарий е свързан с навлизане на гъбата в полов процес (карпогено развитие), който води до формиране на плодни тела, наречени апотеции (фиг. 4), от които се освобождава значително количество аскоспори (Hegedus and Rimmer, 2005). Всеки апотеций може да освободи до 10 милиона аскоспори в рамките на 7 дни, които се поемат от въздушните течения и се пренасят на разстояние 3-4 km. Попаднали върху цветовете на растенията, аскоспорите прорастват и колонизират застаряващите органи (венчелистчета, чашелистчета, полен и др.), след което атакуват прилежащите тъкани. Заразяването се благоприятства от навлажняване на растенията за 16-48 h и температура от 12 до 24 °С. Повечето изследвания показват, че за преминаване на склероциите в карпогено развитие е необходима предварителна подготовка от няколко месеца, при която склероциите са престояли при температура от 0 до 5°C и висока влажност (Sanogo and Puppala, 2007). Наличието на валежи и оптимална температура в границите 20-25°C благоприятства образуването на апотеции и аскоспори, но апотеции могат да се формират и при 5°C ( Wu, et al., 2008; Phillips, 198; Sanogo and Puppala, 2007; Godoy et al., 2017) или 10-15°C (Gupta and Singh, 2017). Апотеции формират само склероциите, разположени върху почвената повърхност или на дълбочина 3-5 cm (Godoy et al. 2017).

Фигура 4. Инициация и формирани апотеции при Sclerotinia sclerotiorum
Броят на формираните апотеции върху един склероций зависи от неговите размери и варира от единични до няколко десетки. Проведен от нас експеримент при полски условия показва, че склероции, поставени върху почвената повърхност и покрити с растителни остатъци от пшеница и царевица през месец октомври, инициират апотецийно формиране в края на месец март (не публикуване данни). Не беше установена инициация във вариантите без растителни остатъци и с растителни остатъци от слънчоглед. Тези резултати показват, че наличието на растителни остатъци върху почвата благоприятства карпогенното развитие на склероциите, поради поддържане на висока влажност.
За условията на България Sclerotinia sclerotiorum има преобладаващо мицелогенно развитие (Saharan and Mehta, 2008; Genchev and Kiryakov 2002). Това именно определя и стратегията за контрол на патогена. Сеитбооборотът е основна превантивна мярка за контрол на гъбата (Saharan and Mehta, 2008) Препоръчително е на площи с доказано развитие на патогена да не се отглеждат култури, които са гостоприемници, за период от 4-5 години. Спазването сроковете на сеитба и сеитбените норми също може да ограничи проявлението и развитието на патогена. По-ранните сеитби на пролетните култури създават условия за загиване на кълновете и пониците, резултат от мицелогенно развитие на склероциите. (O’Sullivan et al., 2021) Високите сеитбени норми създават условия за продължително задържане на влагата, което благоприятства формирането на апотеции в случаите на карпогено развитие на склероциите. (McDonald et al. 2013)
Използването на устойчиви сортове или хибриди се приема за най-ефикасната и ефективна мярка за контрол на болестите (Schwartz and Singh, 2013). Устойчивостта към Sclerotinia sclerotiorum има количествен характер, което утежнява селекцията на устойчивост (Genchev and Kiryakov, 2002; Schwartzand and Singh, 2013). Така например устойчивостта на хибридите слънчоглед е свързана с формата на развитие на заболяването – прикоренова, стъблена и питна (Castano et al., 1993; Van Becelaere and Miller, 2004; Davar et al., 2010). Наши проучвания показват, че хибридите, притежаващи устойчивост към стъбленаат форма, са чувствителни по отношение на прикореновата форма на заболяването. При фасула се съобщава за два механизма на устойчивост (Miklas et al., 2012; Schwartz and Singh, 2013). Първият е свързан с хабитуса на храста. Сортовете с изправен храст предотвратяват нападението през периода на цъфтеж поради по-доброто проветряване на посева и понижаване на влажността. Успоредно с това те разполагат надземните органи (стъбла, листа и бобове) на височина, предотвратяваща допирането им до почвената повърхност, което предотвратява нападението при мицелно развитие на склероциите. Вторият механизъм на устойчивост е свързан с анатомични особености на растенията, които възпрепятстват проникването на патогена в тъканите. Тази устойчивост е известна като физиологична.(Griffiths, 2009; Miklas et al., 1999 ; Mkwaila et al., 2011 ; Pascual et al., 2010)
Използването на фунгициди е един от най-предпочитаните подходи за контрол на болестите при културните растения. По отношение на Sclerotinia sclerotiorum прилагането на фунгициди е оправдано при риск от карпогено развитие на патогена, т.е. при нападение на растенията през периода на цъфтеж. (Peltier et al., 2012 ; Derbyshire and Denton-Giles, 2016; O’Sullivan et al., 2021). Третирането на посевния материал с фунгициди предотвратява нападението в ранните фази от развитието на растенията.(Peltier et al., 2012) В случаите на директна атака на надземната маса на растенията, резултат от мицелогенно развитие на склероциите, прилагането на фунгициди не е ефикасно.
Литература
1. Adams, P. B., & Ayers, W. A. (1979). Ecology of Sclerotinia species. Phytopathology, 69(8), 896-899.
2. Boland, G. J., & Hall, R. (1994). Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology, 16(2), 93-108.
3. Bolton, M.D, Thohmma, B.P.H.J. & Nelson, B.D. (2006). Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, 7(1), 1–16
4. Castaño, F., Vear, F., & de Labrouhe, D. T. (1993). Resistance of sunflower inbred lines to various forms of attack by Sclerotinia sclerotiorum and relations with some morphological characters. Euphytica, 68(1), 85-98.
5. Cohen, S. D. (2023). Estimating the climate niche of Sclerotinia sclerotiorum using maximum entropy modeling. Journal of Fungi, 9(9), 892
6. Davar, R., Darvishzadeh, R., Majd, A., Ghosta, Y., & Sarrafi, A. (2010). QTL mapping of partial resistance to basal stem rot in sunflower using recombinant inbred lines. Phytopathologia Mediterranea, 49(3), 330-341.
7. Derbyshire, M. C., & Denton-Giles, M. (2016). The control of sclerotinia stem rot on oilseed rape (Brassica napus): current practices and future opportunities. Plant Pathol. 65, 859–877. doi: 10.1111/ppa.12517
8. Genchev, D., & Kiryakov, I. (2002). Inheritance of resistance to white mold disease (Sclerotinia sclerotiorum (Lib.) de Bary) in the breeding line A195 of common bean (Phaseolus vulgaris L.).
9. Godoy, O., Stouffer, D. B., Kraft, N. J. & Levine, J. M. (2017). Intransitivity is infrequent and fails to promote annual plant coexistence without pairwise niche differences. Ecology, https://doi.org/10.1002/ecy.1782
10. Griffiths, P. D. (2009). Release of Cornell 601–606: common bean breeding lines with resistance to white mold. HortScience, 44(2), 463-465.
11. Gupta, M., & Singh, K. (2017). Carpogenic germination and viability studies of sclerotia of Sclerotinia sclerotiorum causing lettuce drop. International Journal of Current Microbiology and Applied Sciences, 6(8), 2971-2979.
12. Hegedus, D. D., & Rimmer, S. R. (2005). Sclerotinia sclerotiorum: when “to be or not to be” a pathogen?. FEMS microbiology letters, 251(2), 177-184.
13. Hossain, M. M., Sultana, F., Li, W., Tran, L. S. P., & Mostofa, M. G. (2023). Sclerotinia sclerotiorum (Lib.) de Bary: Insights into the pathogenomic features of a global pathogen. Cells, 12(7), 1063.
14. McDonald, M. R., Gossen, B. D., Kora, C., Parker, M., & Boland, G. (2013). Using crop canopy modification to manage plant diseases. Eur. J. Plant Pathol. 135, 581–593. doi: 10.1007/s10658-012-0133-z
15. Miklas, P. N., Delorme, R., Hannan, R., & Dickson, M. H. (1999). Using a subsample of the core collection to identify new sources of resistance to white mold in common bean. Crop science, 39(2), 569-573.
16. Miklas, P. N., Kelly, J. D., Steadman, J. R., & McCoy, S. (2012). Release of partial white mold resistant pinto USPT-WM-12. Cooperative, 291.
17. Mkwaila, W., & Kelly, J. D. (2011b). Heritability estimates and phenotypic correlations for white mold resistance and agronomic traits in pinto bean. Cooperative, 134.
18. Mkwaila, W., Terpstra, K. A., Ender, M., & Kelly, J. D. (2011a). Identification of QTL for agronomic traits and resistance to white mold in wild and landrace germplasm of common bean. Plant Breeding, 130(6), 665-672.
19. O’Sullivan, C. A., Belt, K., & Thatcher, L. F. (2021). Tackling control of a cosmopolitan phytopathogen: Sclerotinia. Frontiers in Plant Science, 12, 707509. https://doi.org/10.3389/fpls.2021.707509
20. Pascual, A., Campa, A., Pérez-Vega, E., Giraldez, R., Miklas, P. N., & Ferreira, J. J. (2010). Screening common bean for resistance to four Sclerotinia sclerotiorum isolates collected in northern Spain. Plant Disease, 94(7), 885-890.
21. Peltier, A. J., Bradley, C. A., Chilvers, M. I., Malvick, D. K., Mueller, D. S., Wise, K. A., & Esker, P. D. (2012). Biology, yield loss and control of Sclerotinia stem rot of soybean. Journal of Integrated Pest Management, 3(2), B1-B7.
22. Phillips, L. D. (1984). A theory of requisite decision models. Acta psychologica, 56(1-3), 29-48.
23. Rather, R. A., Ahanger, F. A., Ahanger, S. A., Basu, U., Wani, M. A., Rashid, Z., Sofi,P., Singh, V., Javeed, K., Baazeem, A., Alotaibi, S., Wani, O., Khanday, J., Dar, S. & Mushtaq, M. (2022). Morpho-cultural and pathogenic variability of Sclerotinia sclerotiorum causing white mold of common beans in temperate climate. Journal of Fungi, 8(7), 755.
24. Saharan, G. S. & Mehta, N. (2008). Sclerotinia diseases of crop plants: biology, ecology and disease management. Springer Science & Business Media.
25. Sanogo, S., & Puppala, N. (2007). Characterization of a darkly pigmented mycelial isolate of Sclerotinia sclerotiorum on Valencia peanut in New Mexico. Plant Disease, 91(9), 1077-1082.
26. Schwartz, H. F. & Singh, Sh. P. (2013). Breeding Common Bean for Resistance to White Mold: A Review. Crop Sci. 53:1832–1844.
27. Steadman, J. R. (1983). White mold, a serious yield-limiting disease of bean. Plant Disease, 67(4), 346-350.
28. Van Becelaere, G., & Miller, J. F. (2004). Combining ability for resistance to Sclerotinia head rot in sunflower. Crop science, 44(5), 1542-1545.
29. Vasconcellos, R. C., Oraguzie, O. B., Soler, A., Arkwazee, H., Myers, J. R., Ferreira, J. J., Song, Q.; McClean, P.; & Miklas, P. N. (2017). Meta-QTL for resistance to white mold in common bean. PLoS One, 12(2), e0171685.
30. Wu, B. M., Subbarao, K. V., & Liu, Y. B. (2008). Comparative survival of sclerotia of Sclerotinia minor and S. sclerotiorum. Phytopathology, 98(6), 659-665.
31. Zhecheva, K., Koleva, M., & Kiryakov, I. (2024). Sclerotinia sclerotiorum genetic diversity in Bulgaria. Bulgarian Journal of Crop Science, 61(5), 97-104.(Bg)
![MultipartFile resource [file_data]](/assets/img/articles/заглавна-обзор-керанка.jpg)




